Dos o más elementos combinados en una sustancia forman lo que se conoce como un compuesto químico, el cual consiste en átomos unidos mediante enlaces químicos formando moléculas. Se puede formar un enorme número de compuestos químicos por la combinación de unos 120 elementos químicos; hasta la fecha, alrededor de treinta millones han sido caracterizados e identificados.[6] Los compuestos basados en los átomos de carbono e hidrógeno se denominan compuestos orgánicos, y aquellos basados en otros elementos se denominan compuestos inorgánicos. Los compuestos que contienen enlaces entre átomos de carbono y metales se denominan compuestos organometálicos.
Los compuestos en donde los componentes comparten electrones se conocen como compuestos covalentes. Los compuestos que consisten en iones de cargas opuestas estabilizadas por atracción electrostática se conocen como compuestos iónicos o sales.
Compuestos químicos
jueves, 24 de abril de 2008Publicado por Profesora María José en 6:16 0 comentarios
Elementos quìmicos
Una sustancia química que no puede descomponerse o transformarse por procesos químicos ordinarios en una o más sustancias diferentes se conoce como un elemento químico (referido comúnmente como elemento).
Un elemento consiste de partículas llamadas átomos, las cuales consisten en electrones cargados negativamente que giran en torno a un núcleo conformado por protones cargados positivamente y neutrones sin carga. Todos los átomos de un elemento tienen el mismo número de protones, aunque pueden diferir en el número de neutrones, constituyendo distintos isótopos.
Publicado por Profesora María José en 6:15 0 comentarios
Sustancia química
Una sustancia química es cualquier material con una composición química definida, sin importar su procedencia.[1] Por ejemplo, una muestra de agua tiene las mismas propiedades y la misma proporción de hidrógeno y oxígeno sin importar si la muestra se aísla de un río o se crea en un laboratorio.
Una sustancia pura no puede separarse en otras sustancias por ningún medio mecánico.[2]
Sustancias químicas típicas que se pueden encontrar en el hogar son agua, sal (cloruro de sodio) y azúcar (sacarosa). En general, las sustancias existen como sólidos, líquidos, o gases, y pueden moverse entre estos estados de la materia mediante cambios en la temperatura o presión.
El concepto de sustancia química se estableció a finales del siglo XVIII con los trabajos del químico Joseph Proust sobre la composición de algunos compuestos químicos puros tales como el carbonato cúprico.
Publicado por Profesora María José en 6:14 0 comentarios
Ley de Lavoisier
martes, 15 de abril de 2008Como ya sabes, en toda reacción química se forman unos productos a partir de unos reactivos. ¿Pero qué ocurre con las masas de estas sustancias?
Preparamos una disolución de nitrato de plomo en un vaso y otra de yoduro de potasio en otro. Las colocamos en una balanza y comprobamos que entre las dos pesan: 222,1 g.
Después las mezclamos, y vemos que aparece una sustancia nueva (precipitado amarillo): el yoduro de plomo. Nuevamente las colocamos en la balanza y comprobamos que pesan 222,1 g.
La masa no ha variado.

Como una reacción química es una recombinación de los enlaces entre átomos, la masa total antes y después de que se produzca es la misma. Esta idea constituye la ley de conservación de la masa.
El químico Lavoisier enunció por primera vez esta ley, llamada también ley de Lavoisier. Fue el comienzo de la Química moderna.
Ley de Lavoisier: En toda reacción química la suma de las masa de los reactivos es igual a la masa de los productos.
Publicado por Profesora María José en 18:50 0 comentarios
¿Qué ocurre durante una reacción química?
Cuando se introduce un trozo de sodio caliente en el interior de un frasco que contiene gas cloro, se produce una violenta reacción en la que se forma una sustancia nueva, el cloruro de sodio.
Esta reacción se puede expresar así: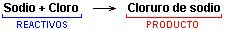
Publicado por Profesora María José en 18:36 0 comentarios
también otros ejemplos de cambios químicos:
Publicado por Profesora María José en 18:31 0 comentarios
Aquí tienes algunos ejemplos más de cambios físicos:
Publicado por Profesora María José en 18:30 0 comentarios
Diferencias entre un cambio físico y un cambio químico

Si doblamos o arrugamos un papel, cambia de aspecto pero sigue siendo papel. Decimos que es un cambio físico. Pero si lo quemamos, al final no queda papel: hay humo y cenizas. Es un cambio químico.
En la naturaleza se producen gran variedad de cambios, como la dilatación de un metal, los cambios de estado del agua, la oxidación de metales, el movimiento de los coches...
Algunos son tan espectaculares como los siguientes:
Cuando vertemos nitrógeno líquido, este hierve vivamente al adquirir la temperatura ambiente.
Se trata de un cambio físico.
La sacarosa (azúcar de mesa) reacciona con clorato de potasio formando nuevas sustancias, como esta extraña masa de carbono.
Se trata de un cambio químico.
En los cambios físicos, las sustancias mantienen su naturaleza y sus propiedades esenciales, es decir, siguen siendo las mismas sustancias.
En los cambios químicos, las sustancias iniciales se transforman en otras distintas, que tienen propiedades diferentes.
Cambio Químico
Publicado por Profesora María José en 18:17 0 comentarios
Reacciones orgánicas
Reacciones de síntesis: 2H2+O2 → 2H2O
Descomposición: FeO2 → ψ Fe+O2
Reacción de Desplazamiento: Cuando dos compuestos A y B reaccionan en un compuesto C: 2Na + 2HCl → 2NaCl + H2
Desplazamiento Doble: Cuando dos compuestos A y B reaccionan en dos compuestos C y D (HCl + NaOH → H20 + NaCl)
Combustión: Combinación de una sustancia combustible con un elemento oxidante (generalmente el oxígeno) generando calor y productos oxidados (ha de ser oxidación a gran escala, o por el contrario no es combustión): C10H8+ 12O2 → 10CO2 + 4H2O
Fragmentación: Cuando un compuesto C reacciona en dos compuestos A y B
Adición: Cuando dos compuestos A y B reaccionan en tres o más compuestos C, D, E
Reordenación: Cuando dos compuestos A y B reaccionan en dos compuestos B y A (Equilibrio de Reaccion)
Publicado por Profesora María José en 18:14 0 comentarios
Reacciones inorgánicas
Ácido-base
La característica que da a los ácidos es su olfato, que se deriva del vocablo acidus, el cual significa "agrio". Esta particularidad es evidente en algunas otras formas cítricas de frutas (limón, naranja) o algunos que contienen ácidos (yogur, vinagre).
El sabor de las bases (muchas de ellas son toxicas) no es tan característico como en los ácidos, pues presentan mayor variedad, pero se puede decir que son ligeramente amargas (jabón, bicarbonato de sodio).
Por otro lado, las bases son resbalosas al tacto (mezcla agua y jabón). Algunas bases son tan fuertes o concentradas que pueden llegar a causar serias lesiones en la piel si el contacto es prolongado.
Los ácidos reaccionan con las proteínas cambiándoles su aspecto físico (Ej: Al agregar jugo de limón (ácido) a la clara de un huevo; que contiene una proteína llamada albúmina, esta última se empieza a solidificar y tomar un color blanquecino).
Una característica compartida es que son electrolíticos, es decir, conducen la corriente eléctrica en disolución acuosa.
Los ácidos tienen un pH menor de 7, cambian el papel tornasol de azul a rojo (Concentración de iones hidroxilo H+(OH)-). Las bases tienen un pH mayor que 7, cambian el papel tornasol de rojo a azul. El pH neutro es 7.
Combustión
La combustión es una reacción química en la que un elemento combustible se combina con otro comburente (generalmente oxígeno en forma de O2 gaseoso), desprendiendo calor y produciendo un óxido; la combustión es una reacción exotérmica debido a su descomposición en los elementos liberados:
calor al quemar.
luz al arder.
Es la combinación rápida de un material con el oxigeno, acompañada de un gran desprendimiento de energía térmica y energía luminosa.
Los tipos más frecuentes de combustible son los materiales orgánicos que contienen carbono e hidrógeno. El producto de esas reacciones puede incluir monóxido de carbono (CO), dióxido de carbono (CO2), agua (H2O) y cenizas.
El proceso de destruir materiales por combustión se conoce como incineración.
Para iniciar la combustión de cualquier combustible, es necesario alcanzar una temperatura mínima, llamada ignición o de inflamación.
Disolución
En química, una disolución (del latín disolutio) o solución es una mezcla homogénea, a nivel molecular de una o más especies químicas que no reaccionan entre sí; cuyos componentes se encuentran en proporción que varía entre ciertos límites.
Toda disolución está formada por una fase dispersa llamada soluto y un medio dispersante denominado disolvente. También se define disolvente como la sustancia que existe en mayor cantidad que el soluto en la disolución. Si ambos, soluto y disolvente, existen en igual cantidad (como un 50% de etanol y 50% de agua en una disolución), la sustancia que es más frecuentemente utilizada como disolvente es la que se designa como tal (en este caso, el agua). Una disolución puede estar formada por uno o más solutos y uno o más disolventes. Una disolución será una mezcla en la misma proporción en cualquier cantidad que tomemos (por pequeña que sea la gota), y no se podrán separar por centrifugación ni filtración.
Un ejemplo común podría ser un sólido disuelto en un líquido, como la sal o el azúcar disuelto en agua (o incluso el oro en mercurio, formando una amalgama)
Se distingue de una suspensión, que es una mezcla en la que el soluto no está totalmente disgregado en el disolvente, sino dispersado en pequeñas partículas. Así, diferentes gotas pueden tener diferente cantidad de una sustancia en suspensión. Mientras una disolución es siempre transparente, una suspensión presentará turbidez, será traslúcida u opaca. Una emulsión será intermedia entre disolución y suspensión.
1.- Son mezclas homogéneas
2.- Al disolver una sustancia, el volumen final es menor que la suma de los volúmenes del disolvente y el soluto
3.- La cantidad de soluto y la cantidad de disolvente se encuentran en proporciones que varían entre ciertos límites. Normalmente el disolvente se encuentra en mayor proporción que el soluto, aunque no siempre es así. La proporción en que tengamos el soluto en el seno del disolvente depende del tipo de interacción que se produzca entre ellos. Esta interacción está relacionada con la solubilidad del soluto en el disolvente. Una disolución que contenga poca cantidad es una disolución diluida. A medida que aumente la proporción de soluto tendremos disoluciones más concentradas, hasta que el disolvente no admite más soluto, entonces la disolución es saturada. Por encima de la saturación tenemos las disoluciones sobresaturadas. Por ejemplo, 100g de agua a 0ºC son capaces de disolver hasta 37,5g de NaCl (cloruro de sodio o sal común), pero si mezclamos 40g de NaCl con 100g de agua a la temperatura señalada, quedará una solución saturada.
4.- Sus propiedades físicas dependen de su concentración:
Disolución HCl (ácido clorhídrico) 12 mol/L Densidad = 1,18 g/cm3
Disolución HCl (ácido clorhídrico) 6 mol/L Densidad = 1,10 g/cm3
5.- Sus componentes se separan por cambios de fases, como la fusión, evaporación, condensación, etc.
6.- Tienen ausencia de sedimentación, es decir al someter una disolución a un proceso de centrifugación las partículas del soluto no sedimentan debido a que el tamaño de las mismas son inferiores a 10 Angstrom ( ºA ).
7.-sus componentes se unen y se genera el solvente mediante el proceso denominadao decontriacion.
Oxidación
La oxidación es una reacción química donde un metal o un no metal cede electrones, y por tanto aumenta su estado de oxidación. La reacción química opuesta a la oxidación se conoce como reducción, es decir cuando una especie química acepta electrones. Estas dos reacciones siempre se dan juntas, es decir, cuando una sustancia se oxida, siempre es por la acción de otra que se reduce. Una cede electrones y la otra los acepta. Por esta razón, se prefiere el término general de reacciones redox. La propia vida es un fenómeno redox. El oxígeno es el mejor oxidante que existe debido a que la molécula es poco reactiva (por su doble enlace) y sin embargo es muy electronegativo, casi como el flúor.
La sustancia más oxidante que existe es el catión KrF+ porque fácilmente forma Kr y F+. Entre varias(KMnO4), el (Cr2O7), el agua oxigenada (H2O2), el ácido nítrico (HNO3), los hipohalitos y los halatos (por ejemplo el hipoclorito sódico (NaClO) muy oxidante en medio alcalino y el bromato potásico (KBrO3)). El ozono (O3) es un oxidante muy enérgico:
Br(-1) + O3 = BrO3(-1)
El nombre de "oxidación" proviene de que en la mayoría de estas reacciones, la transferencia de electrones se da mediante la adquisición de átomos de oxígeno (cesión de electrones) o viceversa. Sin embargo, la oxidación y la reducción puede darse sin que haya intercambio de oxígeno de por medio, por ejemplo, la oxidación de yoduro de sodio a yodo mediante la reducción de cloro a cloruro de sodio:
2NaI + Cl2 → I2 + 2NaCl
Esta puede desglosarse en sus dos hemireacciones correspondientes:
2 I-1 ←→ I2 + 2 e-
Cl2 + 2 e- ←→ Cl2
Si se combina el oxígeno con un no metal forma óxidos ácidos también llamados anhídridos y caracterizados por ser de tipo ácido (actúan como ácido).
Ejemplo
El hierro puede presentar dos formas oxidadas.
Fe2O2 → FeO
Fe2O3
Reducción
En química, reducción es el proceso electroquímico por el cual un átomo o ion gana uno o varios electrones. Implica la disminución de su estado de oxidación. Este proceso es contrario al de oxidación.
Cuando un ion o átomo se reduce:
Gana electrones
Actúa como agente oxidante
Es reducido por un agente reductor
Disminuye su estado o número de oxidación
Por ejemplo, el hierro (III) puede ser reducido a hierro (II):
Fe3+ + e- → Fe2+
En química orgánica, la disminución de enlaces de átomos de oxígeno a átomos de carbono o el aumento de enlaces de hidrógeno a átomos de carbono se interpreta como una reducción. Por ejemplo:
HC≡CH → H2C=CH2 (el etino se reduce para dar eteno)
CH3COH → CH3CH2OH (el etanal se reduce a etanol)
Neutralización
Una reacción de neutralización es una reacción entre un ácido y una base. Generalmente, en las reacciones acuosas ácido-base se forma agua y una sal. Así pues, se puede decir que la neutralización es la combinación de iones hidrógeno y de iones hidróxido para formar moléculas de agua. Durante este proceso se forma una sal. Las reacciones de neutralización son generalmente exotérmicas, lo que significa que producen calor.
Generalmente la siguiente reacción ocurre:
ácido+ base → sal + agua
En esta reacción de neutralización se puede usar una solución indicadora tal como la fenolftaleina (si los elementos a neutralizar son ácido clorhídrico e hidróxido de Sodio), pero también se puede usar el azul de safranina, el azul de metileno, etc. para saber si esa solución contiene alguna base.
Ejemplo: Na(OH) + H2CO3 → NaHCO3 + H2O
Publicado por Profesora María José en 18:08 0 comentarios
Reacciones Químicas
Una reacción química es todo proceso químico en el que una o más sustancias (reactivos o reactantes) sufren transformaciones químicas para convertirse en otra u otras (productos). Esas sustancias pueden ser elementos o compuestos. Un ejemplo de reacción química es la formación de óxido de hierro producida al reaccionar el oxígeno del aire con el hierro.
A la representación simbólica de las reacciones se las llama ecuaciones químicas.
Los productos obtenidos a partir de ciertos tipos de reactivos dependen de las condiciones bajo las que se da la reacción química. No obstante, tras un estudio cuidadoso se comprueba que, aunque los productos pueden variar según cambien las condiciones, determinadas cantidades permanecen constantes en cualquier reacción química. Estas cantidades constantes, las magnitudes conservadas, incluyen el número de cada tipo de átomo presente, la carga eléctrica y la masa total.
Publicado por Profesora María José en 17:57 0 comentarios
Programas de Astronomia
Datos personales

- Profesora María José
- Estación Central, Santiago, Chile
- Profesora de General Básica con mención en Computación
Mi lista de blogs
-
REUNIÓN CON ALUMNOSHace 17 años
-
LIRICA: ESTROFAS Y VERSOSHace 17 años
-
Región Magallanes y de la Antártica ChilenaHace 17 años
-
-
Archivo del blog
-
▼
2008
(52)
-
▼
abril
(11)
- Compuestos químicos
- Elementos quìmicos
- Sustancia química
- Ley de Lavoisier
- ¿Qué ocurre durante una reacción química?
- también otros ejemplos de cambios químicos:
- Aquí tienes algunos ejemplos más de cambios físicos:
- Diferencias entre un cambio físico y un cambio quí...
- Reacciones orgánicas
- Reacciones inorgánicas
- Reacciones Químicas
-
▼
abril
(11)
Consultas
Guía Nº1
2.- La célula está dividiendo (reproducciendo) y la flor se abre ante la luz (responde a un estímulo)
Guía Nº2
b.- La razón de montar el frasco B, es para demostrar que un frasco que está en contacto solo con el aire externo, y no con las moscas, tampoco ocurre generación espontánea, ya que es imposible que ingresen los huevos de las moscas.
2.- a.-Pasteur colocó caldo nutritivo en matraces de cuello recto y cuello cisne, lo hizo hervir para matar microorganismos existentes en ambos matraces.Al cabo de un tiempo, observo que en el caldo nutritivo del matraz del cuello recto había abundantes miroorganismos, en cambio en el de cuello cisne no, ya que estos quedaban atrapados en el cuello del matraz.
b..-Pasteur demostró que en el aire hay gran cantidad de microorganismos, que son los responsables de la descomposición de la orgánica.
Guía Nº3
b.- Falta el paso desde las moléculas orgánicas hasta el origen de una célula.
Guía Nº4
2.-a.- Porque las partículas orgánicas en nuestro planeta son producidas por seres vivos. mSI el origen de dichas partículas es el mismo en cualquier planeta del Universo, entonces también debe existir seres vivos.
b.- Depende de las evidencias, ya sea observaciones o resultados experimentales, que permitan aceptar o rechazar los planetamientos que explican el origen de la vida.
Guía Nº5
3.- a.- Inalterados
b.- Alterados
c.- Inalterados
d.- Evidencias de organismos.
4.- En sus definiciones no debe faltar la idea de que los organismos que pertenecen a una misma especie tienen la capacidad de reproducirse y dejar descendencia.
Guía Nº 6
b.- El tamaño del pico de las especies pinzones sera distinto cuando viven en la misma isla, ya que a través de las generaciones se han producido cambios en esta estructura que les ha permitido consumir alimentos de distinto tipo (una especie come semillas más grandes y la otra semillas más pequeñas), evitando así la competencia entre los organismos. Cuando las especies viven separadas, consumen el mismo tipo de alimento dado que no existe(ni ha existido) competencia por el alimento.





